|
�@��������(complex)�Ƃ́u�����C�I���ɔz�ʎq���z�ʂ����������v�ƒ�`����܂��B�������̂͂��ꂼ��Ɠ��̍\�������Ă��܂��B���Ƃ��ΓS���̃C�I���ł���[Fe(CN)6]4-�͐����ʑ̍\�������Ă��܂��B�܂��A�u�G�}�v�Ƃ��Ă̓����̂��߁A���@���w�ȊO�̕���ł����ɏd�v�Ȉʒu�Â��ɂ���܂��B
�@����͂����������u�J�ڋ������́v�ɂ��ė��_�ʂ���������Ă��������Ǝv���܂��B
�@
�@�z�ʎq(ligand)�ɂ͑����̎�ނ�����܂����A���̂��̂̔z�ʎq�����ʂƂ��Ď������́A�u���L�d�q�������͕��d�ׂ������Ă����v�Ƃ������Ƃł��B����͒��S�������ʏ�d�q�s���Ő��d�ׂ�ттĂ��邱�Ƃ��l����ƁA���ɓ��R�̂��ƂƂ�����ł��傤�B
�@�z�ʎq�͈�����艽�J���z�ʂł��邩�A�Ƃ����ϓ_���番�ނ���邱�Ƃ������ł��B��J���݂̂ŋ����Ɣz�ʂł���z�ʎq�͒P���z�ʎq�A��J���Ŕz�ʂł���͓̂���z�ʎq�A�O�J���͎O���z�ʎq�c�Ƃ������O�ŌĂ�܂��B
�@��\�I�Ȕz�ʎq�̗���ȉ��ɂ����Ă����܂��B
|
|
���� |
���� |
���w�\���� |
|
|
�n���Q�������C�I�� |
�@ |
F-, Cl-, Br-,
I- |
|
�V�A�������C�I�� |
�@ |
CN- |
|
�A�����j�A |
�@ |
NH3 |
|
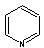
�s���W�� |
py |
|
|
�g���t�F�j���z�X�t�B�� |
�@ |
PP��3 |
|
|
�G�`�����W�A�~�� |
en |
H2NCH2CH2NH2 |
|
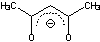
�A�Z�`���A�Z�g�i�[�g |
acac |
|
|
|
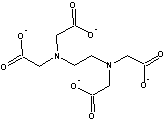
�G�`�����W�A�~���e�g���|�_�C�I�� |
edta |
|
�@
�@
�@�J�ڋ����̏ꍇ�A�z�ʐ��͎��ۂ�2�`9�z�ʂ̂��̂����݂��܂����A�d�q�I�E���̓I�ɂ������4�`6�z�ʂ̍��̉��������������݂��܂��B6�������Ƃ���ʓI�ł��B7�z�ʈȏ�ɂȂ�Ɨ��̏�Q�̂��߁A�������z�ʎq�ł�������ɑ��݂����Ȃ��Ȃ�܂��B�������邱�Ƃ̑������̍\�����ȉ��Ɏ����Ă����܂��B
|
|
���̍\�� |
|
�� |
|
|
���l�ʑ̌^(Td) |
|
[CoCl4]2-, [Ni(CO)4],
etc |
|
�������ʌ^(D4h) |
|
[Pt(NH3)4]2+,
[AuCl4]-, etc�@ |
|
|
�O�p�����^(D3h) |
|
[Fe(CO)5], etc�@ |
|
�l�p���^(C4v) |
|
[VO(H2O)4], etc�@�@ |
|
|
�����ʑ̌^(O��) |
|
[Fe(CN)6]4-, [Ni(en)3]2+,
[Co(NH3)6]3+, etc�@ |
�@�z�ʎq�����ׂē�����ނłȂ��ꍇ(��F[PtCl2(NH3)2]
etc)�A�L�@���q�Ɠ����悤�ȍl�����ɂ��A�ِ��̂���w�ِ��̂����݂����܂��B
�@
�@���S�������q�ł���J�ڋ����́Ad�O���ƌĂ��d�q�O���������܂��B�z�ʎ��ɂ͂���d�O�����d�v�Ȗ������ʂ����܂��B���ꂼ���d�O���͉��Ɏ����悤�Ɋp�x�ˑ��I�Ȃ̂ŁA�ǂ�d�O���ɓd�q�����݂��邩�ɂ���ċ����̓d�q���z���ω����A�z�ʎq���z�ʂ��₷���p�x�Ƃ������̂��ł��Ă��܂��B�����z�ʐ��ł����̂̍\�����������݂���̂́A����-�z�ʎq�̑g�ݍ��킹�E���ݍ�p�ɂ�����ed�O���̃G�l���M�[���x���ɈႢ���ł������Ƃ����R�Ȃ̂ł��B
�@���̂悤�ȃG�l���M�[���x���̈Ⴂ�́A�Ód�����ꗝ�_(electrostatic
crystal field theory)�ɂ���Đ�������܂��B���ۂ̔z�ʌ����͋��L�����ƃC�I�������̍����肠���������ł����A���̗��_�ł��z�ʌ����̓C�I���������ł����A�Ɖ��肵�A�ߎ��������f�����l���܂��B
�@���Ƃ��A���_�ɒ��S�����Axyz�������ɔz�ʎq���������ʑ̃��f���\��(���})���ɂƂ��Ă݂܂��B
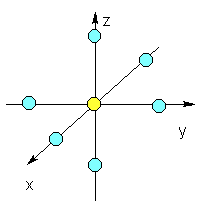
�@�z�ʎq�̑��݂��Ȃ��Ƃ��A�J�ڋ�����5��d�O���͏k�ނ��Ă���A���ׂē������G�l���M�[�������܂��B���̂Ƃ��̓d�q���x���z��5��d�O���̏d�ˍ��킹�ɂ�����Ώ̏��ɂȂ�܂��B�������Ȃ���A���d�ׂ����z�ʎq���߂Â��Ă���ƁA�O���d�q�Ɣz�ʎq�̓d�ׂƂ̔����������Ad�O���̃G�l���M�[���x���̕��N����܂��Bdz2��dx2-y2�O���͎������ɍő�̓d�q���x�������߁A�����Ƃ��������傫���A���ݍ�p�ɂ��G�l���M�[���x�����㏸���܂��B���̌��ʁA�����ʑ̌^(Oh)�ł͉��̂悤��d���O����d�ËO���ւƕ��N���A�������ւ̓d�q���z�����Ȃ��Ȃ�悤�ȃG�l���M�[���x�����Ƃ�܂��B���l�̍l�@�����l�ʑ̌^(Td)�A���ʐ����^(D4h)�ł��s���A�ȉ��̐}�̂悤�ɂ��ꂼ��d�O�������邱�Ƃ�������܂��B
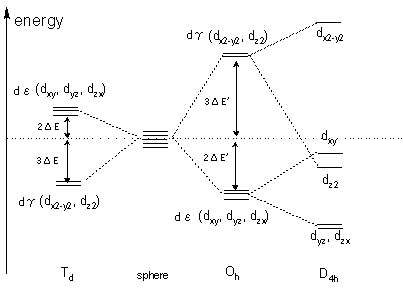
���̂悤�ɕ����O���ւ́APauli�̔r���������Hund�̋K���ɏ]���ċ���d�d�q���l�߂��܂��B����d�d�q������d�O���ɓ��邱�Ƃɂ���ē�������艻�G�l���M�[����������艻�G�l���M�[(CFSE)�Ƃ����܂��B���Ƃ��ATi(�V)��d�d�q����1�ł��B���ꂪ�����ʑ̍��\�����Ƃ�ꍇ�A���Ώ̏���G�l���M�[�̒Ⴂd�ËO����d�d�q���l�߂��邽�߁A���̕���������艻�G�l���M�[��2��E'�����������邱�ƂɂȂ�܂��B
�@���̂̏ꍇ�A�O���G�l���M�[�I�ɒႢ�g�ݍ��킹�����ɂ����Ă��A�s�Γd�q������đ��݂���ق�������ȏꍇ������܂��B���Ƃ��Ad�d�q��7�̐����ʑ̍��̂ŁA(d��,
d��)�ɂ��ꂼ��(1, 6)�A(2,
5)�Ƌl�߂�d�q�̋l�߂������l���܂��B���R�O���G�l���M�[�I�ɂ͑O�҂̂ق����L���Ȃ̂ł����A�����O����2�̓d�q������ƁA�����Ód������p�������邽�߁A������x�s����ɂȂ�܂��B�܂�A��������艻�G�l���M�[�̓x����(��E)���傫�����͋O���G�l���M�[�I�ɗL���ȕ�(�O��)���Ƃ�A��E���������ꍇ�͓d�q�Ό`���������悤�ȕ�(���)�̔z�u���Ƃ�܂��B�s�Γd�q���̏��Ȃ��z�u����X�s���z�u�A�����z�u�����X�s���z�u�Ƃ����܂��B���l�̍l�@��d�d�q�̐�������Ă��A�܂����l�ʑ̌^�A���ʐ����^�\���ł��s���܂��B
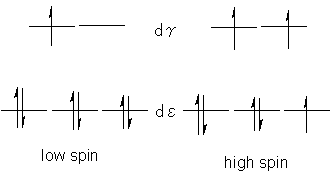
�@
�@�Ód�����ꗝ�_�ł́A�z�ʌ��������S�ȃC�I�����������ƌ��Ȃ��Ă��܂������A���ۂ͋��L�������������炩�܂܂�܂��B������l���������_���z�ʎq�ꗝ�_(ligand
field
theory)�ł��B�����ꗝ�_�ł͋����̂���d�d�q�O���������l�����܂������A�z�ʎq�ꗝ�_�ł͔z�ʎq�d�q������d�d�q�Ɠ����ɍl���܂��B���̂��߁A���q�O���@�I�ȍl�@�������ė��_�͐i�݂܂��B
�@���Ƃ��A[Co(NH3)6]3+�ł́A���q�O�����ݍ�p�͉��}�̂悤�ɂȂ�A�G�l���M�[�̒Ⴂ�O������Pauli�̔r������Hund�̋K���ɏ]���ēd�q���l�܂��Ă����A�Ƃ����v���Z�X�ŋc�_����܂��B����͒ʏ�̕��q�O���@�ƑS�����l�ł��̂ŁA�ڂ������Ƃ͏ȗ����܂��B�Q�l�T�C�g�ɕ��q�O���@�̃T�C�g���Ƃ肠���Ă����܂����̂ł����������B
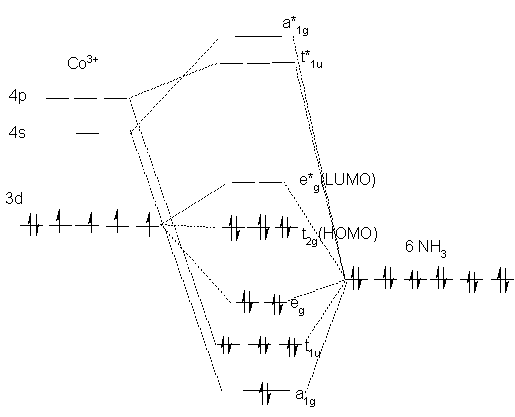
�@�z�ʎq�ꗝ�_�̋��͂ȂƂ�����Ό����̋O�����ݍ�p�����l�ɋc�_���ł���_�ł��B�Ό����̕��q�O���Ƒ��ݍ�p����̂͋���d�O���ł��B���ɋ�̃O��������_���Y�fCO�Ȃǂ̔z�ʎq�̏ꍇ�A�z�ʂƋt�����ɁA�܂�������q�����*�O���֓d�q�����ꍞ�ށA�t���^(back-donation)�Ƃ������ۂ��N����Ad�d�q�̑������������S���q�̍��̂́A�����艻����܂��B
�@
�@�����̉��d�q�Ɣz�ʎq�̉��d�q�����v��������18�ł���Ƃ��A�J�ڋ����̗L�@�����������͈��萫�������A�Ƃ����o�������m���Ă��܂��B�����18�d�q���Ƃ����܂��B
�@��������������ɂ�Cr(CO)6�Ȃǂ�����܂����ACo(C5H5)2�ȂǁA18�d�q�łȂ��Ă�����ɑ��݂�������������������̂Œ��ӂ��ĉ������B
�@����̘b�͗��_���S�������̂ŁA���X����Ȃ��Ă��܂��܂������������ł������H�������̂̎��ۂ̉��p��Ȃǂ͎���҂ł��b���������Ǝv���܂��B
�i2002.3.8 by�@cosine)
�@
�@ �E�u���w����R�[�X ���@���w�v�ē����Y
��g���X
�E�u���@���w�v�ؓc�Εv �։ؖ[
�E�u����̖��@���w�v�������� �O���o��
�@ �E �������w�u���q21�r�L�@�J�ڋ����������A�����q���� �������w�u���q21�r�L�@�J�ڋ����������A�����q����
�@�i�m�e�N�m���W�[�ɑΉ������A�̋���L�@�����������A�t���[�������̂�f���h���}�[���́A����ɂ̓��^�Z�V�X��s�Ĕ����G�}�p�̍��̂Ȃǂ��lj��B �@ �@ �@
�E�w�Q�_�X�J�ڋ����ɂ��L�@����
�@�L�@�������u���l�̂��߂̋��ȏ��B�J�ڋ������̂̃^�C�v�ɂ��͂��\�����A�S�ґ����̔�����������A������P���ȑJ�ڋ��������̃p�^�[���ʼn���B�J�ڋ������̂̊W���锽�����ł���悤�ɂȂ�B |
